特医食品注册流程及材料
2026-01-20 来自: 中智坤健康科技有限公司 浏览次数:49
特医食品的注册流程极为严格,遵循 “药品级”的管理模式,以确保其安全性和科学性。整个过程由国jia市场监督管理总局(国jia药监局)下属的特殊食品安全监督管理司负责。
以下是特医食品在中国境内的注册流程及所需核心材料的详细说明。
一、注册流程全景图
整个流程可以概括为 “三步走”,但每一步都包含大量细致工作,全程通常需要1.5年至3年甚至更久。
一阶段:研发与验证(临床前研究)
这是企业自行完成的基础,为申报做准备。
1. 产品研发:基于医学和营养学理论,确定产品配方、工艺、质量指标。
2. 试验验证:进行稳定性试验、安全性评估、工艺验证等。
3. 临床研究(特定全营养配方必需):在医疗机构开展临床试验,验证其对于目标人群的有效性和安全性。
二阶段:行政审评审批(核心官方流程)
这是与监管部门互动的核心环节,流程如下图所示:
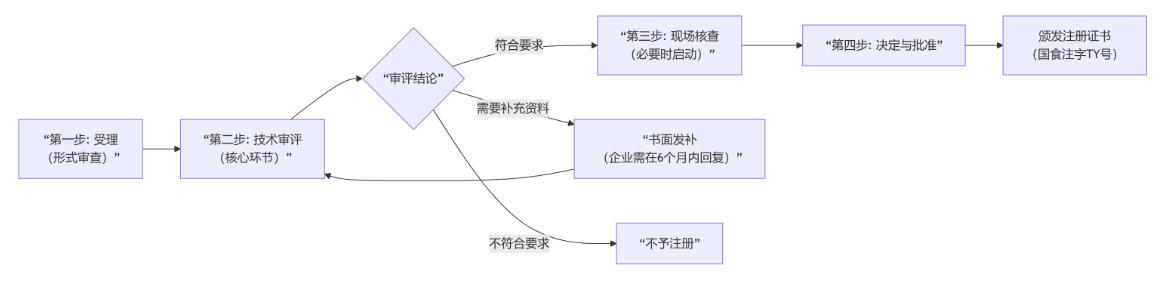
三阶段:获批后管理
1. 生产许可:获得注册证书后,生产企业还需向省级市场监管部门申请取得 “特殊食品生产许可证”。
2. 上市后监管:产品上市后,需接受持续的市场监督、抽样检验、不良反应监测等。
二、各环节核心材料要求
以下是在“行政审评审批”阶段,申请人需提交的核心材料清单:
一部分:证明产品安全性与科学性的材料
1. 产品研发报告:详述配方设计依据、研发过程、筛选过程等。
2. 产品配方材料:
◦ 完整配料表、用量、营养成分表。
◦ 营养成分的来源和含量选择依据(特别是可选择性成分)。
◦ 食品添加剂、营养强化剂的选用必要性说明。
3. 生产工艺材料:详细工艺流程图、步骤说明、关键控制点及参数。
4. 产品质量标准:对原料、感官、理化指标、污染物、微生物等做出明确规定。
5. 产品检验报告:由有资质的检验机构出具的全项目检验报告(型式检验)。
6. 产品稳定性研究材料:证明在保质期内各项指标稳定的试验数据。
7. 安全依据材料:证明产品安全性的文献、试验数据等。
二部分:证明产品有效性的材料(核心!)
8. 临床评价材料:
◦ 全营养/非全营养配方:可提交国内外相关科学文献、法规依据等进行分析评价。
◦ 特定全营养配方:提交在中国境内开展的临床试验报告。试验需符合《特殊医学用途配方食品临床试验质量管理规范》,通常需要至少1-3家临床试验机构,样本量有严格要求。
三部分:证明生产能力的材料
9. 生产条件:生产厂房的平面图、车间环境监测报告等。
10. 质量管理体系文件。
11. 检验条件和能力:实验室仪器、人员等证明。
四部分:其他行政与标签材料
12. 产品标签、说明书样稿:符合《特殊医学用途配方食品标签、说明书》要求,明确标注“小蓝花”标志、注册号、适用人群、食用方法、警示语等。
13. 产品名称:与注册批准的名称一致。
14. 申请人资质证明:营业执照、研发能力证明等。
15. 其他材料:如原料的安全性证明、产品未上市销售声明等。
三、关键与难点
1. 极高门槛:研发、资金、时间投入巨大。仅临床试验一项就可能花费数千万元人民币和数年时间。
2. 特定全营养配方是难点:临床试验是最大的技术壁垒,其方案设计、执行和结果分析要求极高。
3. 材料科学性:所有提交的资料基于充分的科学依据,逻辑严密,数据可靠。
4. 动态核查:审评过程中,审评机构可能随时要求补充材料、说明情况,甚至启动现场核查。

特医食品的注册是一个系统性、长周期、高投入、强监管的工程。其核心目标是确保产品:
• 安全可靠:对脆弱人群无健康风险。
• 营养科学:配方有充分的医学营养学依据。
• 质量可控:生产全过程稳定合规。
• 真实有效:临床效果经过科学验证。
因此,一个拥有“国食注字TY”编号和“小蓝花”标志的产品,其背后代表的是国jia层面的严格审核和企业的强大实力,这也是其与普通食品、保健品的根本区别所在。
相关推荐:


